
- Avtor Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:40.
- Nazadnje spremenjeno 2025-01-22 17:09.
Klor izotopa z 18 nevtroni ima številčnost 0,7577 in masno število 35 amu. Za izračun povprečno atomsko maso, pomnožite ulomek z masnim številom za vsako izotopa , nato jih dodajte skupaj.
Podobno, kakšno je tehtano povprečje vseh izotopov elementa?
Uporaba množice različnih izotopi in kako obilna vsaka izotopa je, lahko najdemo povprečno masa atomov an element . Atomska masa an element ali je Povprečna teža maso atomov v naravnem vzorcu element . Atomska masa se običajno poroča v enotah atomske mase.
kaj ima maso 1 amu? Enota atomske mase (simbolizirana AMU ali amu) je opredeljena kot natančno 1/12 mase atoma ogljika-12. Atom ogljika-12 (C-12) ima šest protoni in šest nevtroni v svojem jedru. Z nenatančnimi izrazi je ena AMU povprečje proton masa počitka in nevtrona masa počitka.
Drugič, kako izračunate odstotek številčnosti z uporabo atomske mase?
Spremenite vsakega odstotka obilja v decimalno obliko z deljenjem s 100. To vrednost pomnožite z atomska masa tega izotopa. Dodajte skupaj za vsak izotop, da dobite povprečje atomska masa.
Kakšna je razlika med atomsko maso in atomsko težo?
Atomska masa (ma) ali je maso od an atom . Samski atom ima določeno število protonov in nevtronov, torej maso je nedvoumen (ne bo spremenil) in je vsota števila protonov in nevtronov v atomu . Atomska teža je tehtano povprečje maso od vseh atomi elementa, ki temelji na številčnosti izotopov.
Priporočena:
Kako najdete manjkajočo številko, če dobite povprečje?

Srednja vrednost niza številk je povprečje teh številk. Srednjo lahko najdete tako, da dodate nabor številk in delite s številom podanih številk. Če vam je dana srednja vrednost in vas prosimo, da iz nabora poiščete manjkajoče število, uporabite preprosto enačbo
Kako najdete standardno deviacijo in povprečje v Excelu?
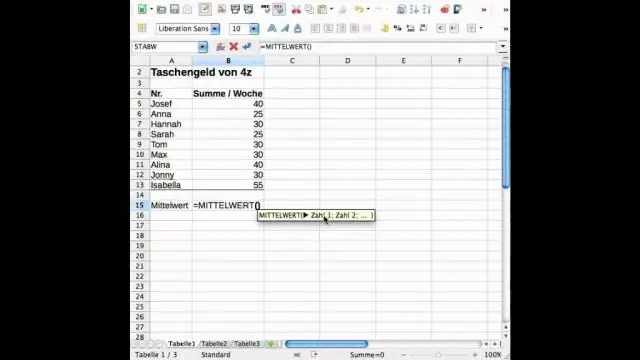
Standardna deviacija je merilo, koliko variance je v nizu številk v primerjavi s povprečjem (povprečjem) števil. Za izračun standardnega odklona v Excelu lahko uporabite eno od dveh primarnih funkcij, odvisno od nabora podatkov. Če podatki predstavljajo celotno populacijo, lahko uporabite STDEV. Pfunkcija
Kako ustvarite tehtano povprečje v vrtilni tabeli?

Tehtana povprečja v vrtilni tabeli Kliknite puščico navzdol poleg besede vrtilna tabela na levi strani orodne vrstice vrtilne tabele. Izberite formule | Izračunana polja. V polje Ime vnesite ime za novo polje. V polje Formula vnesite formulo, ki jo želite uporabiti za svoje tehtano povprečje, kot je =WeightedValue/Weight. Kliknite V redu
Kako najdete povprečje na grafu?
Če želite poiskati povprečje, dodajte števila in vsoto delite s številom seštevancev
Kako najdete vzorčno povprečje v statistiki?
Formula za iskanje povprečja vzorca je: = (Σ xi) / n. Vse, kar pravi formula, je seštevanje številk v vašem naboru podatkov (Σ pomeni "seštej" in xi pomeni "vse številke v naboru podatkov)"
