
- Avtor Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:40.
- Nazadnje spremenjeno 2025-01-22 17:09.
Kot primer vez entalpija disociacije, do zlomiti 1 mol plinastih molekul vodikovega klorida v ločene atome plinastega vodika in klora porabi 432 kJ. The vez disociacijska entalpija za H-Cl vez je +432 kJ mol-1.
| vez entalpija (kJ mol-1) | |
|---|---|
| C-Cl | +346 |
| H-Cl | +432 |
Pozneje se lahko vprašate tudi, kako izračunate energijo, potrebno za prekinitev vezi?
Energija vezi je definiran z vsoto vseh obveznice zlomljeno minus vsota vseh obveznice oblikovana: ΔH = ∑H( obveznice zlomljeno) - ∑H( obveznice oblikovana). ΔH je sprememba v vezno energijo , imenovan tudi vez entalpija in ∑H je vsota vez energije za vsako stran enačba.
Lahko se tudi vprašamo, zakaj je za prekinitev vezi potrebna energija? Energija je zahtevano do pretrgati vezi . Atomi so veliko srečnejši, ko so "poročeni" in izpuščeni energija ker je lažje in bolj stabilno biti v razmerju (npr. generirati oktetne elektronske konfiguracije). Sprememba entalpije je negativna, ker se sistem sprošča energija pri oblikovanju vez.
Poleg tega, koliko energije je potrebno za prekinitev vodikove vezi?
V vodi vodikove vezi , vodik atom je kovalentno vezan na kisik molekule vode (492,2145 kJ ˣ mol-1 [350]), vendar ima (optimalno) dodatno privlačnost (približno 23,3 kJ mol-1 [168]. To je energija (ΔH) potrebna za zlom the vez in popolnoma ločijo atome.
Ali prekinitev vezi sprosti energijo?
Lomljenje in izdelava vezi Energija se absorbira v pretrgati vezi . Bond - zlom je endotermni proces. Energija je izpustil ko je nov obveznice oblika. Ali je reakcija endotermna ali eksotermna, je odvisno od razlike med energija potrebno pretrgati vezi in sproščena energija ko je nov obveznice oblika.
Priporočena:
Kakšna je razlika med energijo vezi in energijo disociacije vezi?

Glavna razlika med energijo vezi in energijo disociacije je v tem, da je energija vezi povprečna količina energije, ki je potrebna za razgradnjo vseh vezi med istima dvema vrstama atomov v spojini, medtem ko je energija disociacije vezi količina energije, ki je potrebna za razgradnjo določene nehomolize vezi
Koliko atomov v molekuli na sliki lahko tvori vodikove vezi z vodo?

Dr. Haxton je svojemu razredu povedal, da lahko molekula vode ustvari 4 vodikove vezi, ki so vse v isti ravnini kot trije atomi
Koliko vezi lahko tvori ogljikov atom in zakaj?

štiri Poleg tega, zakaj je pomembno, da ogljik tvori 4 vezi? Ogljik je edini element, ki lahko oblika toliko različnih spojin, ker vsaka ogljik atom lahko oblika štiri kemične obveznice na druge atome in ker ogljik atom je ravno prave, majhne velikosti, da se udobno prilega kot deli zelo velikih molekul.
Koliko kovalentnih vezi ima fluor?

7 obveznic
Kako nastavim pogojno prekinitev v Intelliju?
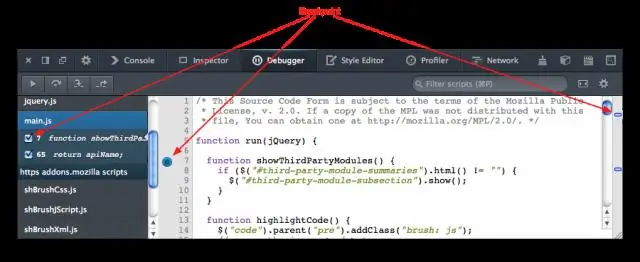
Če želite ustvariti pogojno prekinjeno točko, preprosto kliknem z desno tipko miške na simbol prekinitvene točke in vnesem pogoj. ** Pogoj je katera koli adhoc Java koda, ki se bo prevedla v kontekstu prekinitvene točke in vrnila Boolean. Tako bi lahko naredil 'Pogoj' i==15, potem bi se prelomna točka morala sprožiti šele, ko je i enak 15
